En este artículo te explicamos de una forma fácil en qué consiste esta área de la física, cuáles son sus leyes, principios y algunos ejemplos de cómo sus resultados se aplican en la vida cotidiana.
La termodinámica es la rama de la física que se ocupa del estudio de los vínculos existentes entre el calor y las demás variedades de energía. Analiza, por lo tanto, los efectos que poseen a nivel macroscópico las modificaciones de temperatura, presión, densidad, masa y volumen en cada sistema. El término “termodinámica” proviene del griego thermós, “calor” y dynamos, “poder, fuerza”.
El estudio formal de la termodinámica se inició gracias a Otto von Guericke en 1650, un físico y jurista alemán que diseñó y construyó la primera bomba de vacío, refutando con sus aplicaciones a Aristóteles y su máxima de que “la naturaleza aborrece el vacío”. Luego de esta invención, los científicos Robert Boyle y Robert Hooke perfeccionaron sus sistemas y observaron la correlación entre presión, temperatura y volumen. Así nacieron los principios de la termodinámica.
La importancia práctica radica fundamentalmente en la diversidad de fenómenos físicos que describe. En consecuencia, el conocimiento de esta diversidad ha derivado haca una enorme productividad tecnológica.
¿Qué estudia la termodinámica?
En la termodinámica se estudian y clasifican las interacciones entre diversos sistemas termodinámicos. Un sistema termodinámico se caracteriza por sus propiedades, relacionadas entre sí mediante las ecuaciones de estado. Estas se pueden combinar para expresar la energía interna y los potenciales termodinámicos, útiles para determinar las condiciones de equilibrio entre sistemas, los procesos espontáneos y el intercambio de energía con su entorno.
¿Cuáles son las leyes de la termodinámica?
Los principios de la termodinámica se enunciaron durante el siglo XIX, los cuales regulan las transformaciones termodinámicas, su progreso, sus límites. Realmente, son axiomas reales basados en la experiencia en la que se basa toda la teoría.
En concreto, se pueden distinguir tres principios básicos, más un principio de «cero» que define la temperatura y que está implícito en los otros tres.
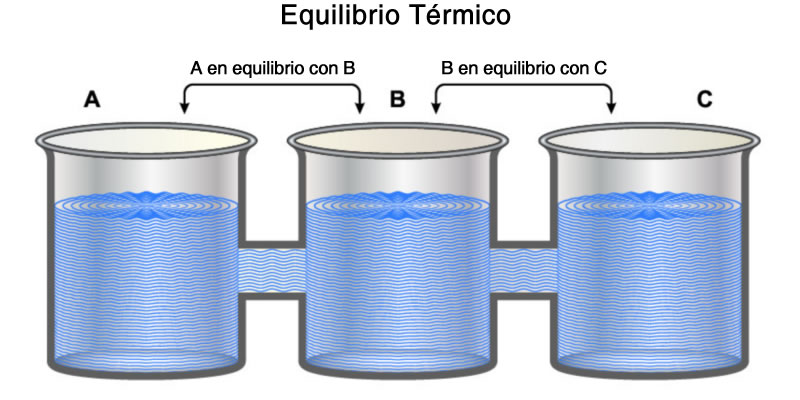
Principio cero de la termodinámica
La ley cero de la termodinámica afirma que cuando dos sistemas que interactúan están en equilibrio térmico, comparten algunas propiedades, que pueden medirse dándoles un valor numérico preciso. En consecuencia, cuando dos sistemas están en equilibrio térmico con un tercero, están en equilibrio entre sí y la propiedad compartida es la temperatura.
Primer principio termodinámico
El primer principio de la termodinámica, también conocido como primera ley de la termodinámica, establece que “la energía no se crea ni se destruye, solo se transforma“. Esto quiere decir que si se realiza trabajo sobre un sistema o bien éste intercambia calor con otro, la energía interna del sistema cambiará.
Más formalmente, este principio se descompone en dos partes:
El “principio de la accesibilidad adiabática” (en termodinámica, adiabático quiere decir que no intercambia calor con su entorno), que dice que “el conjunto de los estados de equilibrio a los que puede acceder un sistema termodinámico cerrado es, adiabáticamente, un conjunto simplemente conexo“.
El “principio de conservación de la energía”, que establece que “el trabajo de la conexión adiabática entre dos estados de equilibrio de un sistema cerrado depende exclusivamente de ambos estados conectados“.
Visto de otra forma, la primera ley de la termodinámica permite definir el calor como la energía necesaria que debe intercambiar un sistema para compensar las diferencias entre trabajo y energía interna. Fue propuesta por Nicolas Léonard Sadi Carnot en 1824, en su obra “Reflexiones sobre la potencia motriz del fuego y sobre las máquinas adecuadas para desarrollar esta potencia“, en la que expuso los dos primeros principios de la termodinámica. Esta obra fue incomprendida por los científicos de su época, y más tarde fue utilizada por Rudolf Clausius y William Thomson (primer barón Kelvin, más conocido como Lord Kelvin) para formular, de una manera matemática, las bases de la termodinámica.
Segundo principio termodinámico:
Hay varias declaraciones de la segunda ley de la termodinámica, todas equivalentes, y cada una de las formulaciones enfatiza un aspecto particular. En primer lugar, afirma que «es imposible realizar una máquina cíclica que tenga el único resultado de transferir calor de un cuerpo frío a un cuerpo cálido» (declaración de Clausius). Por lo tanto, la transferencia de calor siempre va del cuerpo caliente al cuerpo frío.
Por otra parte, también se puede afirmar, de manera equivalente, que “es imposible llevar a cabo una transformación cuyo resultado sea solo el de convierte el calor tomado de una sola fuente en trabajo mecánico” (declaración de Kelvin).
Tercer principio termodinámico:
El tercer principio de las leyes de la termodinámica está estrechamente relacionado con este último, y en algunos casos se considera como consecuencia de este último. En este sentido, puede afirmarse diciendo que «es imposible alcanzar el cero absoluto con un número finito de transformaciones» y proporciona una definición precisa de la magnitud llamada entropía.
Adicionalmente, la tercera ley de la termodinámica también establece que la entropía para un sólido perfectamente cristalino, a la temperatura de 0 kelvin es igual a 0.
¿En qué áreas se aplica la termodinámica?
La termodinámica se puede aplicar a una amplia variedad de temas de ciencia e ingeniería, tales como motores, transiciones de fase, reacciones químicas, fenómenos de transporte, e incluso agujeros negros.
A continuación enumeramos algunos ejemplos de algunas de sus aplicaciones:
Alimentación. La cocina el caliente es un constante ejemplo de transformaciones químicas a través de procesos termodinámicos.
Ciencia de los materiales. En este caso se utilizan procesos térmicos para obtener nuevos tipos de materiales que posean propiedades químicas y físicas bien definidas.
Aplicaciones industriales. En el mundo industrial existen muchos procesos que transforman materias primas en productos acabados utilizando maquinaria y energía. Un ejemplo es la industria cerámica donde unos largos hornos túnel cuecen ladrillos a temperaturas superiores a los 800 grados Celsius.
Arquitectura. En el campo de la construcción es muy importante tener en cuenta las transferencias térmicas entre el exterior y el interior de la vivienda. En la arquitectura bioclimática la termodinámica juega un papel fundamental, por lo que se estudian en detalle todos los aspectos de la energía solar pasiva.
Generación de electricidad. En todas las centrales térmicas (combustibles fósiles, energía nuclear o centrales solares) se utilizan estos conceptos para conseguir accionar turbinas de vapor y generadores eléctricos.
El estudio termodinámico resulta de gran importancia en el caso de la energía solar térmica debido a que este tipo de instalaciones solares se basan en el intercambio de calor.
En definitiva, los resultados termodinámicos son esenciales para otros campos de la física y la química, ingeniería química, ingeniería aeroespacial, ingeniería mecánica, biología celular, ingeniería biomédica, y la ciencia de materiales para nombrar algunos.
¿Necesitas medir, registrar o transmitir mediciones en temperatura? Recuerda que en Veto cuentas con toda una amplia gama de instrumentos y soluciones para temperatura para diversas aplicaciones y necesidades. Si quieres conocer nuestros ofereta en esta área, haz click AQUI

